如图所示装置: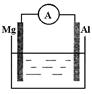
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。两极反应式为:
正极 ;负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,总反应方程为 。
如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。两极反应式为:
正极 ;负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,总反应方程为 。