(能力提高)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠的氯化钠。某学生设计了如下方案: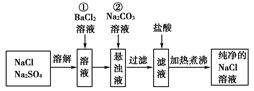
如果此方案正确,那么:
(1)操作①是否可改为加硝酸钡溶液?为什么?
(2)进行操作①后,如何判断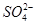 已除尽,方法是__________________________。
已除尽,方法是__________________________。
(3)操作②的目的是________,为什么不先过滤后再加碳酸钠溶液?理由是________________________________________________________________________。
(能力提高)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①是否可改为加硝酸钡溶液?为什么?
(2)进行操作①后,如何判断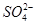 已除尽,方法是__________________________。
已除尽,方法是__________________________。
(3)操作②的目的是________,为什么不先过滤后再加碳酸钠溶液?理由是________________________________________________________________________。