下图是木炭还原氧化铜的实验装置图,按要求回答下列问题。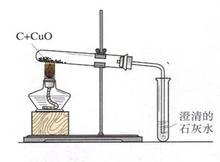
(1)酒精灯加网罩的目的 ;
(2)刚开始加热,澄清的石灰水中立即产生气泡,但澄清的石灰水不变浑浊,原因是 ;
(3)继续加热,观察到的现象: ; 。
下图是木炭还原氧化铜的实验装置图,按要求回答下列问题。
(1)酒精灯加网罩的目的 ;
(2)刚开始加热,澄清的石灰水中立即产生气泡,但澄清的石灰水不变浑浊,原因是 ;
(3)继续加热,观察到的现象: ; 。