( 10分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。已知:CO(g) + H2O(g) H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
t1℃时物质浓度(mol/L)的变化
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量 (填增大、减小或不变)。
②表中3 min~4 min之间反应处于 状态;CO的体积分数 16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为 。
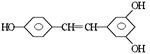 ,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是mol。
,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是mol。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号