在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答: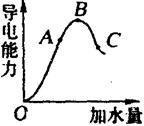
(1)“O”点导电能力为“0”的理由是_______________________。
(2)A、B、C三点pH值由大到小的顺序是_______________________。
(3)A、B、C三点电离度最大的是____________________。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答:
(1)“O”点导电能力为“0”的理由是_______________________。
(2)A、B、C三点pH值由大到小的顺序是_______________________。
(3)A、B、C三点电离度最大的是____________________。