在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=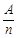 (K为A与n的比值)。请用编号回答下列问题:
(K为A与n的比值)。请用编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____性越强
(2)当A一定时,K值越小,则元素的_____性越强
(3)当K=0,则该元素系_____元素,当K=l时,则该元素系_____元素,当K<1时,则该元素系____元素。
在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=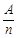 (K为A与n的比值)。请用编号回答下列问题:
(K为A与n的比值)。请用编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____性越强
(2)当A一定时,K值越小,则元素的_____性越强
(3)当K=0,则该元素系_____元素,当K=l时,则该元素系_____元素,当K<1时,则该元素系____元素。