下列A ~ D是初中化学中的四个实验,请按要求填空: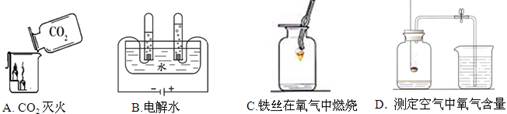
 (1)A实验中观察到的现象是 。
(1)A实验中观察到的现象是 。
(2)B实验中正极产生的气体是 (写化学式);由此实验得出水是由 组成的。
(3)C实验中观察到的现象为剧烈燃烧、 、生成一种黑色固体;反应的化学方程式 。
(4)D实验燃烧匙中所盛药品红磷要过量,其原因是 。
下列A ~ D是初中化学中的四个实验,请按要求填空:
 (1)A实验中观察到的现象是 。
(1)A实验中观察到的现象是 。
(2)B实验中正极产生的气体是 (写化学式);由此实验得出水是由 组成的。
(3)C实验中观察到的现象为剧烈燃烧、 、生成一种黑色固体;反应的化学方程式 。
(4)D实验燃烧匙中所盛药品红磷要过量,其原因是 。