实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液。
Ⅱ.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
Ⅲ.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
(1)滴定达到终点的现象是 ① ,此时锥形瓶内溶液的pH范围为 ② 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。
甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
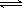 2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是(填写编号)
2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是(填写编号) CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下: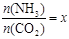 ,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是。
,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是。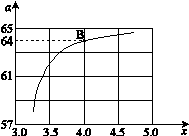
 CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。 CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号