(6分)右图所示装置有多种用途,请回答下列问题: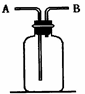
(1)检验:证明CO中混有CO2,装置内应盛
(2)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填A或B,下同);若收集比空气重的气体,则气体从 端通入。
(6分)右图所示装置有多种用途,请回答下列问题:
(1)检验:证明CO中混有CO2,装置内应盛
(2)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填A或B,下同);若收集比空气重的气体,则气体从 端通入。