水杨酸甲酯又叫冬青油,是一种重要的有机合成原料。某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
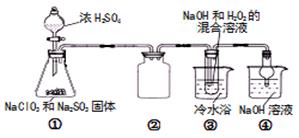
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:

Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g。
常用物理常数:
名称
|
分子量
|
颜色状态
|
相对密度
|
熔点(℃)
|
沸点(℃)
|
水杨酸甲酯
|
152
|
无色液体
|
1.18
|
-8.6
|
224
|
水杨酸
|
138
|
白色晶体
|
1.44
|
158
|
210
|
甲醇
|
32
|
无色液体
|
0.792
|
-97
|
64.7
|
请根据以上信息回答下列问题:
(1)仪器A的名称是,制备水杨酸甲酯时,最合适的加热方法是。
(2)实验中加入甲苯对合成水杨酸甲酯的作用是。
(3)反应结束后,分离甲醇的操作是。
(4)洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是。
(5)检验产品中是否含有水杨酸的化学方法是。
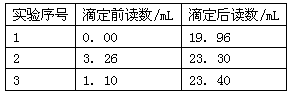
(6)本实验的产率为___________(保留两位有效数字)。


 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。

 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号