已知乳酸的结构简式为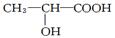 。试回答:
。试回答:
(1)乳酸分子中含有 和 两种官能团。
(2)乳酸跟氢氧化钠溶液反应的化学方程式:
(3)乳酸跟足量的金属钠反应的化学方程式:
(4)乳酸跟乙醇发生酯化反应生成的酯的结构简式为:
(5)相等的乳酸分别和足量的钠和碳酸氢钠反应生成气体的物质的量之比为
已知乳酸的结构简式为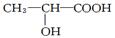 。试回答:
。试回答:
(1)乳酸分子中含有 和 两种官能团。
(2)乳酸跟氢氧化钠溶液反应的化学方程式:
(3)乳酸跟足量的金属钠反应的化学方程式:
(4)乳酸跟乙醇发生酯化反应生成的酯的结构简式为:
(5)相等的乳酸分别和足量的钠和碳酸氢钠反应生成气体的物质的量之比为