一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示, 
(1)O点导电能力为0的理由是 。
(2)a、b、c三点溶液的c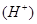 由小到大的顺序是 。
由小到大的顺序是 。
(3)a、b、c三点醋酸的电离程度最大的是 。
(4)要使c点c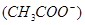 增大,c
增大,c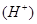 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法)
① ;② ;③ 。
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示, 
(1)O点导电能力为0的理由是 。
(2)a、b、c三点溶液的c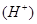 由小到大的顺序是 。
由小到大的顺序是 。
(3)a、b、c三点醋酸的电离程度最大的是 。
(4)要使c点c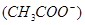 增大,c
增大,c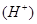 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法)
① ;② ;③ 。