雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生(其中的S元素均为—2价)。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 溶液[或CuSO4溶液]吸收。(均写化学式)
(3)As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。酸性:HNO3 H3AsO4(填“>”、“=”或“<”)。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
 CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;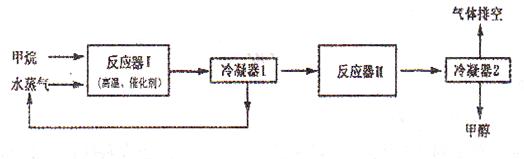
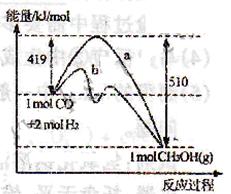
 _____________。
_____________。
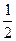 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。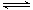 2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。 __。
__。
 如下实验:
如下实验: 粤公网安备 44130202000953号
粤公网安备 44130202000953号