将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:2 H2(气) + CO(气) 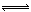 CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率 ;
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率 ;
(2)CO的转化率 ;
(3)求相同条件下CH3OH(气) 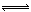 2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K
将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:2 H2(气) + CO(气) 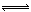 CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率 ;
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率 ;
(2)CO的转化率 ;
(3)求相同条件下CH3OH(气) 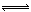 2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K