黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2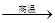 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO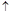 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I—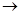 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
 、
、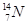 、
、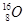 、
、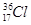 、
、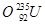 、
、 中;
中; 粤公网安备 44130202000953号
粤公网安备 44130202000953号