下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。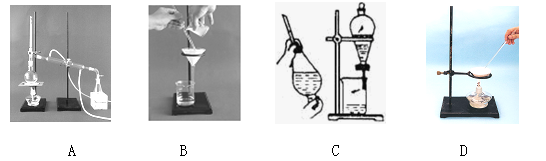
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ;
(2)从碘水中提取碘 ;
(3)用自来水制取蒸馏水 ;
(4)分离植物油和水 ;
(5)除去粗盐中的泥沙 ;
(6)与海水晒盐原理相符的是 。
下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ;
(2)从碘水中提取碘 ;
(3)用自来水制取蒸馏水 ;
(4)分离植物油和水 ;
(5)除去粗盐中的泥沙 ;
(6)与海水晒盐原理相符的是 。