在容积相同的不同密闭容器中内,分别充入同量的N2和H2,在不同温度下,任其发生反应:3H2 + N2 2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。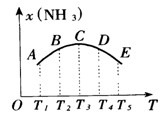
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是_____________。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,试从化学反应速率和化学平衡角度说明理由。
在容积相同的不同密闭容器中内,分别充入同量的N2和H2,在不同温度下,任其发生反应:3H2 + N2 2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是_____________。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,试从化学反应速率和化学平衡角度说明理由。