海带中含有丰富的碘元素,某化学研究性学习小组用如下流程从海水中提取碘: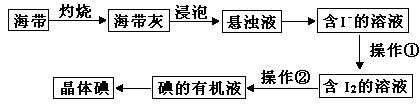
(1)若操作①为通入适量的Cl2,则发生反应的离子方程式为 。
(2)操作②的名称是 ,所用的玻璃仪器有 ,可以选用的有机溶剂是 (填一种)。
海带中含有丰富的碘元素,某化学研究性学习小组用如下流程从海水中提取碘:
(1)若操作①为通入适量的Cl2,则发生反应的离子方程式为 。
(2)操作②的名称是 ,所用的玻璃仪器有 ,可以选用的有机溶剂是 (填一种)。