(14分)当归素是治疗偏头痛的有效新药。某研究小组开发了如下合成路线来合成该药。
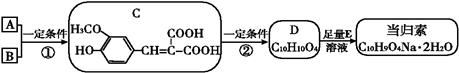
已知:①A的相对分子质量为104,1 mol A与足量的碳酸氢钠反应生成44.8 L气体(标准状况);
②B的结构中含有醛基;③C在一定条件下生成有机酸D;
④RCHO+HOOC—CH2COOH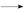 RCH=C(COOH)2+H2O
RCH=C(COOH)2+H2O
RCH=C(COOH)2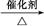 RCH=CHCOOH+CO2↑。请回答下列问题。
RCH=CHCOOH+CO2↑。请回答下列问题。
(1)A的分子式是 ,B的结构简式为 。
(2)C可能发生的反应是_________(填序号)。
| A.氧化反应 |
B.水解反应 |
C.消去反应 |
D.酯化反应 |
(3)反应②的化学方程式为 。
(4) E的名称为 。
(5) 符合下列条件的D的同分异构体共有 种,其中在核磁共振氢谱中只出现五组峰的物质的结构简式为 。
①苯环上只有两个取代基;②苯环上的一氯代物只有两种;
③1 mol该同分异构体与足量的碳酸氢钠反应生成2 mol CO2。