某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
淀粉溶液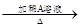 混合物
混合物
混合物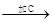 红色沉淀D
红色沉淀D
(1)各步加入的试剂为:
A________,B__________,C__________。
(2)加入A溶液而不加入B溶液是否可以________(填“可以”或“不可以”),其理由是_____________________________________________________________。
(3)若析出1.44 g红色沉淀,淀粉的水解率是__________。
某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
淀粉溶液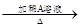 混合物
混合物
混合物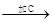 红色沉淀D
红色沉淀D
(1)各步加入的试剂为:
A________,B__________,C__________。
(2)加入A溶液而不加入B溶液是否可以________(填“可以”或“不可以”),其理由是_____________________________________________________________。
(3)若析出1.44 g红色沉淀,淀粉的水解率是__________。