现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: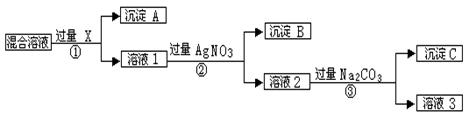
请回答下列问题:
⑴写出实验流程中下列物质的化学式
试剂X : 沉淀A: 沉淀B:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式
试剂X : 沉淀A: 沉淀B:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。