(8分)如图所示,已知A、D、E、F是中学常见的单质,B、C是氧化物,且B是红棕色固体,请填空: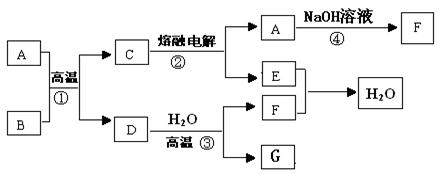
(1)A 是 , B是 。(填化学式)
(2)写出反应③的化学方程式为 。
(3)写出反应④的化学方程式为 。
(4)C电解时,每生成1molA ,同时生成 molE。
(8分)如图所示,已知A、D、E、F是中学常见的单质,B、C是氧化物,且B是红棕色固体,请填空:
(1)A 是 , B是 。(填化学式)
(2)写出反应③的化学方程式为 。
(3)写出反应④的化学方程式为 。
(4)C电解时,每生成1molA ,同时生成 molE。