海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下: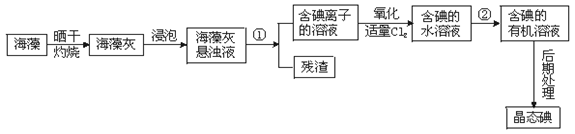

(1)A仪器的名称是 ,B仪器的名称是 。
(2)指出提取碘的过程中有关的实验操作名称:① 、② ;
(3)提取碘的过程中,可供选择的有关试剂是 。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,酒精 | D.汽油,甘油(易溶于水) |
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处并改正:
① 、② .
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:

(1)A仪器的名称是 ,B仪器的名称是 。
(2)指出提取碘的过程中有关的实验操作名称:① 、② ;
(3)提取碘的过程中,可供选择的有关试剂是 。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,酒精 | D.汽油,甘油(易溶于水) |
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处并改正:
① 、② .