已知反应:①101 kPa时,2H2(g)+O2(g) ==2H2O(g) 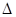 H="-483.6" kJ/mol
H="-483.6" kJ/mol
②稀溶液中,H+(aq)+OH-(aq)==H2O(l) 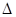 H="-57.3" kJ/mol
H="-57.3" kJ/mol
又知由H2和O2两种气体反应生成1 mol液态水比生成1mol气态水多放出44kJ热量。下列结论中正确的是( )
| A.H2的燃烧热为285.8 kJ/mol |
B.H2和O2反应生成液态水时的热化学方程式为H2(g) +1/2O2(g)=H2O(l)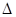 H="-571.6" kJ/mol H="-571.6" kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号