2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。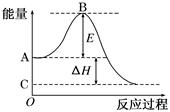
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示: _____;C点表示: (填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示: _____;C点表示: (填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。