(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)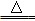 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式___________________________________________。
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应,Cl2是________(同上)产物。
(3)当0.1 mol MnO2参加反应时,转移电子数为________,被氧化的HCl为________ mol。
(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式___________________________________________。
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应,Cl2是________(同上)产物。
(3)当0.1 mol MnO2参加反应时,转移电子数为________,被氧化的HCl为________ mol。