.(1)利用VSEPR推断分子或离子的空间构型。PO ;CS2 ;AlBr3(共价分子) 。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式: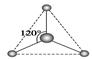 __________;
__________; __________。
__________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
.(1)利用VSEPR推断分子或离子的空间构型。PO ;CS2 ;AlBr3(共价分子) 。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式: __________;
__________; __________。
__________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。