W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为_________,X为________,Y为_________,Z为__________。
(2)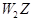 是由___________键组成的分子,其电子式为______________。
是由___________键组成的分子,其电子式为______________。
(3)由Y、X、W组成的物质中有_______键和_______键组成的_______化合物。
W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为_________,X为________,Y为_________,Z为__________。
(2)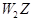 是由___________键组成的分子,其电子式为______________。
是由___________键组成的分子,其电子式为______________。
(3)由Y、X、W组成的物质中有_______键和_______键组成的_______化合物。