[化学——选修三:物质结构与性质]
2011年3月11日日本发生了9.0级强地震。福岛第一核电站1号机组12日下午发生氢气爆炸。随后在爆炸核电站周围检测到的放射性物质有碘-131和铯—137,碘-131一旦被人体吸入,可能会引发甲状腺疾病。日本政府计划向核电站附近居民发放防止碘-131辐射的药物碘片。
(1)Cs(铯)的最外层电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素A、B、C的电离能如下表:
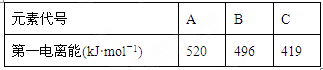
那么三种元素C的元素符号为____________,形成其单质晶体的化学键类型__________。
(2)F、Cl、Br与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别是________、________。与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物,非金属氯化物等。BCl3是一种非金属氯化物,该物质分子中B—Cl键的键角为________。基态溴原子的简化电子排布式为 _____。
(3)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为_________。
(4)测定气态氟化氢分子量总大于20,你认为可能的原因为。
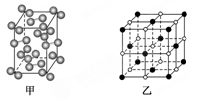
(5)碘—131是碘单质,其晶胞结构如下图甲所示,该晶胞中含有________个I2分子;KI的晶胞结构如下图乙所示,每个K+紧邻________个I-。