(1)常温下有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,比较盐酸、HX、HY、HZ四种酸酸性由强到弱
(2)已知25°C时:

氢氟酸是一种弱酸,可用来刻蚀玻璃。20ml0.1mol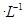 的氢氟酸与0.1mol/L
的氢氟酸与0.1mol/L
氢氧化钠溶液完全反应时放热aJ,写出氢氟酸电离的热化学方程式
(1)常温下有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,比较盐酸、HX、HY、HZ四种酸酸性由强到弱
(2)已知25°C时:

氢氟酸是一种弱酸,可用来刻蚀玻璃。20ml0.1mol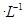 的氢氟酸与0.1mol/L
的氢氟酸与0.1mol/L
氢氧化钠溶液完全反应时放热aJ,写出氢氟酸电离的热化学方程式