下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。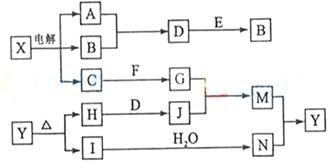
请回答下列问题:
(1)B中所含元素位于周期表中 周期 族
(2)A在B中燃烧的现象是 。
(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)= 。
(4)G+J→M的离子方程式是 。
(5)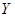 受热分解的化学方程式是 。
受热分解的化学方程式是 。
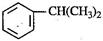 ),是一种重要的有机化工原料。
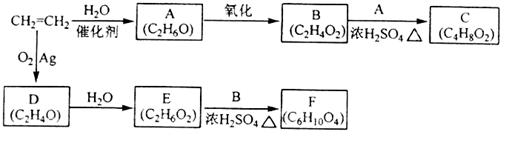
),是一种重要的有机化工原料。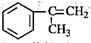 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。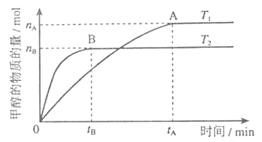
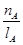 mol·L-1·min-1
mol·L-1·min-1 增大
增大

 粤公网安备 44130202000953号
粤公网安备 44130202000953号