(7分)现有含1mol Fe3+和1molAl3+的混合溶液,按下图横坐标依次加入NaOH溶液、盐酸、通入CO2气体,纵坐标为混合沉淀的物质的量。
(1)请画出沉淀的物质的量随反应的变化曲线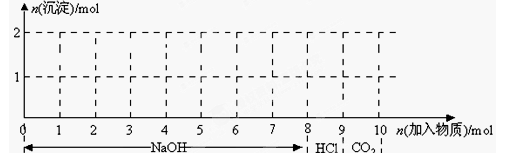
(2)逐步写出:6-7、9-10反应的离子方程式:____________________________________。
(7分)现有含1mol Fe3+和1molAl3+的混合溶液,按下图横坐标依次加入NaOH溶液、盐酸、通入CO2气体,纵坐标为混合沉淀的物质的量。
(1)请画出沉淀的物质的量随反应的变化曲线
(2)逐步写出:6-7、9-10反应的离子方程式:____________________________________。