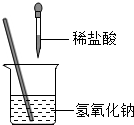
金属钛(Ti)是21世纪最重要的金属之一。某化学兴趣小组的同学为探究铝、铜、钛的金属活动顺序,做了如下实验:①先用砂布将金属表面擦光亮。②将大小、厚薄相同的三种金属片分别放入到盛有相同体积的同种盐酸的试管中,观察到的现象如下:
| 金属 |
钛 |
铝 |
铜 |
| 与盐酸反应的现象 |
放出气泡缓慢 |
放出气泡快 |
无现象 |
(1)依据上表现象推断三种金属的活动性顺序从强到弱为: ,把金属钛放在硫酸铜溶液中能否发生反应? (填“能”或“不能”);
(2)根据三种金属的性质和用途回答:①建筑常用铝合金做门窗,原因是 (答2点);
②把钛或钛合金放在海水中数年,取出后仍光亮如新,这说明金属钛具有很强的 性。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号