(8分)在一定条件下可实现下图所示物质之间的变化: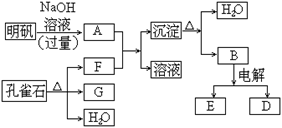
请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。上图中的F的电子式为 。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式 。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式 。
(4)D与NaOH溶液反应的化学方程式为(用单线桥标出电子转移的方向及数目) 。
(8分)在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。上图中的F的电子式为 。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式 。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式 。
(4)D与NaOH溶液反应的化学方程式为(用单线桥标出电子转移的方向及数目) 。