(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知:
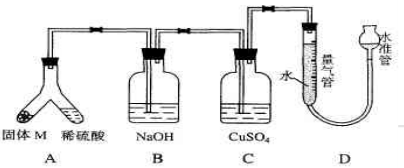
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥