( 9分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。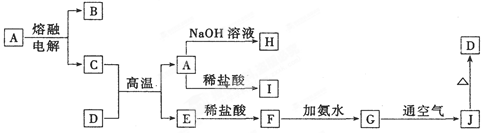
请回答下列问题:
(1)A物质为________。
(2)C与D在高温下的反应在冶金工业上称为 反应,化学方程式为________ 。
(3)G→J的化学方程式为_________________________________。
(4)A→H的离子方程式为____________________________________。
( 9分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:
(1)A物质为________。
(2)C与D在高温下的反应在冶金工业上称为 反应,化学方程式为________ 。
(3)G→J的化学方程式为_________________________________。
(4)A→H的离子方程式为____________________________________。