在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g) 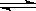 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g) 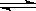 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O ( mol/L) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
 CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:


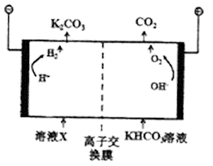
 H2(g)+CO2(g);△H=-41.2kJ/mol.生成的CO2与H2以不同的体积比混合时在合适的条件下反应可制得CH4.
H2(g)+CO2(g);△H=-41.2kJ/mol.生成的CO2与H2以不同的体积比混合时在合适的条件下反应可制得CH4.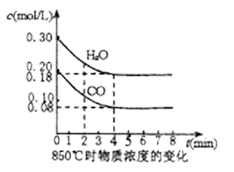
 粤公网安备 44130202000953号
粤公网安备 44130202000953号