如下图所示,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题: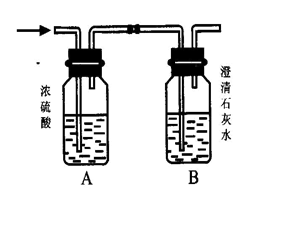
(1) 若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是_____________。
(2) 若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是____________。
(3) 若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)
| ① |
② |
③ |
④ |
⑤ |
| |
|
|
|
|
如下图所示,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题: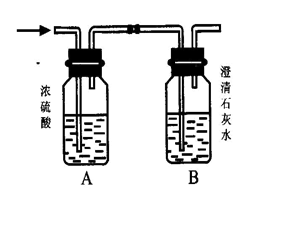
(1) 若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是_____________。
(2) 若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是____________。
(3) 若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)
| ① |
② |
③ |
④ |
⑤ |
| |
|
|
|
|