某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。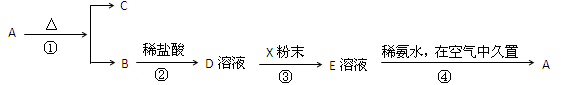
(1)请写出下列物质的化学式:A 、C 。
(2)在①②③④各步反应中属于氧化还原反应的有 (填序号)。
(3)请分别写出反应①的化学方程式和反应③的离子方程式:① 、③ 。
某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
(1)请写出下列物质的化学式:A 、C 。
(2)在①②③④各步反应中属于氧化还原反应的有 (填序号)。
(3)请分别写出反应①的化学方程式和反应③的离子方程式:① 、③ 。