常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题: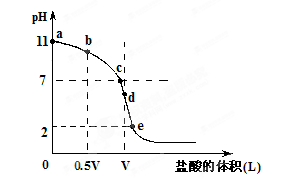
(1)氨水的电离方程式为 ,该温度时氨水的电离平衡常数K= 。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为 。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 。
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式) 。
| A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-) |
| B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+) |
| C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
(5)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 。
 CHCOOH。试写出它与下列物质反应的方程式。
CHCOOH。试写出它与下列物质反应的方程式。 2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。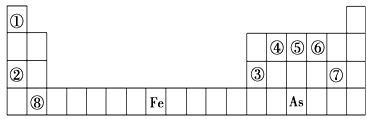
 粤公网安备 44130202000953号
粤公网安备 44130202000953号