下图是100 mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识填空: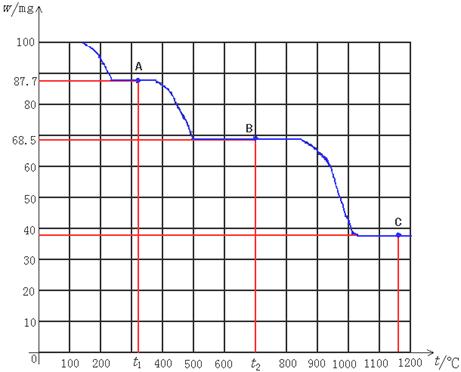
(1)温度分别为t1和t2时,固体产物的化学式A是________,B是________。产物C的化学式为 。
(2)由A得到B的化学方程式为___________________________________。
下图是100 mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识填空:
(1)温度分别为t1和t2时,固体产物的化学式A是________,B是________。产物C的化学式为 。
(2)由A得到B的化学方程式为___________________________________。