写出有关反应方程式
(1) 由苯制溴苯_______________________________
(2) 由乙炔制聚氯乙烯_______________________________________
(3) 杯状化合物A可作为金属离子配合物的配体,其结构如图:选用均不超过10个碳原子的两种有机物为原料,经缩合生成A。_________________________________。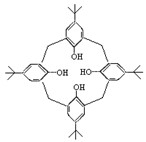
写出有关反应方程式
(1) 由苯制溴苯_______________________________
(2) 由乙炔制聚氯乙烯_______________________________________
(3) 杯状化合物A可作为金属离子配合物的配体,其结构如图:选用均不超过10个碳原子的两种有机物为原料,经缩合生成A。_________________________________。