已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。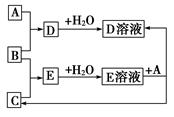
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。
已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。