实验室以含有Mg2+、Cl—、Br—、SO42—等离子的卤水为主要原料制备Mg和Br2,流程如下: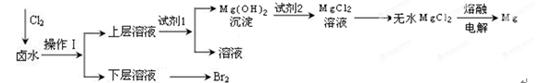
(1)操作Ⅰ使用的试剂是 ;所用主要仪器的名称是 。
(2)为了使Mg2+转化为沉淀,试剂1可以选用 ;加入试剂1后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂2可以选用 。
(4)请写出由无水MgCl2生成Mg的化学反应方程式 。
实验室以含有Mg2+、Cl—、Br—、SO42—等离子的卤水为主要原料制备Mg和Br2,流程如下:
(1)操作Ⅰ使用的试剂是 ;所用主要仪器的名称是 。
(2)为了使Mg2+转化为沉淀,试剂1可以选用 ;加入试剂1后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂2可以选用 。
(4)请写出由无水MgCl2生成Mg的化学反应方程式 。