(附加题1)以A和乙醇为基础原料合成香料甲的流程图如下: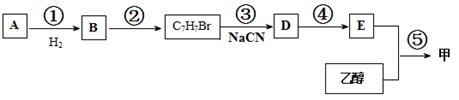
已知:R—Br+NaCN → R—CN+NaBr; R—CN 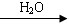 R—COOH
R—COOH
杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全燃烧时,生成15.4g CO2和2.7g H2O。
(1)A的分子式
(2)写出反应⑤的化学方程式
(附加题1)以A和乙醇为基础原料合成香料甲的流程图如下:
已知:R—Br+NaCN → R—CN+NaBr; R—CN 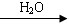 R—COOH
R—COOH
杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全燃烧时,生成15.4g CO2和2.7g H2O。
(1)A的分子式
(2)写出反应⑤的化学方程式