粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:
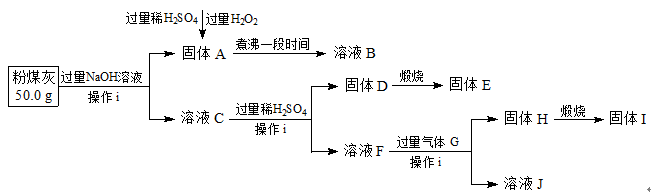
请回答下列问题:
(1)操作i所需要的玻璃仪器有:(填序号)。
a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗
(2)写出粉煤灰与过量NaOH溶液反应的离子方程式。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式。
(4)写出生成固体H的离子方程式。
(5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量:
①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是
(请用化学方程式表示)。
②判断滴定终点的现象为。
③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
滴定次数
|
1
|
2
|
3
|
4
|
KI溶液体积/mL
|
30.00
|
32.20
|
30.02
|
29.98
|
则该粉煤灰中Fe元素的质量分数为(保留三位有效数字)。
④若滴定操作太慢,则滴定结果(填“偏小”、“偏大”或“无影响”);原因是
(请用离子方程式及简单的文字描述)。