下面列出了几组物质,请将物质的合适组号填写在空格上。
同位素 ,同素异形体 ,同分异构体 ,同系物 。
①金刚石与“足球烯”C60; ②氧气(O2)与臭氧(O3) ; ③16O、17O和18O;
④ D与T ; ⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥CH4和CH3CH2CH3;
⑦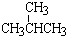 和
和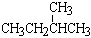 ; ⑧
; ⑧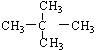 和
和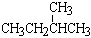 ;
;
⑨
下面列出了几组物质,请将物质的合适组号填写在空格上。
同位素 ,同素异形体 ,同分异构体 ,同系物 。
①金刚石与“足球烯”C60; ②氧气(O2)与臭氧(O3) ; ③16O、17O和18O;
④ D与T ; ⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥CH4和CH3CH2CH3;
⑦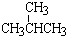 和
和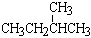 ; ⑧
; ⑧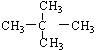 和
和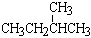 ;
;
⑨