(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下: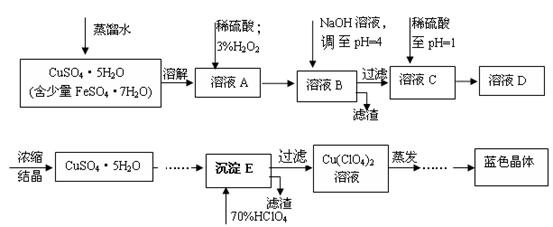
已知:
| 离子 |
溶液pH值 |
|
| 开始沉淀 |
沉淀完全 |
|
| Fe2+ |
7.6 |
9.6 |
| Fe3+ |
2.7 |
3.7 |
| Cu2+ |
5.2 |
6.4 |
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。



 和环丙烷的不饱和度为1,
和环丙烷的不饱和度为1,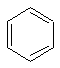 和
和 的不饱和度为4。由此推断,维生素A的不饱和度为
的不饱和度为4。由此推断,维生素A的不饱和度为 粤公网安备 44130202000953号
粤公网安备 44130202000953号