、、、、五种元素分属三个短周期,且原子序数依次增大。、同主族,可形成离子化合物;、同主族,可形成、两种分子。
请回答下列问题:⑴ 在元素周期表中的位置为
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是
⑶ 、的单质或两元素之间形成的化合物可作水消毒剂的有
⑷ 的燃烧热,写出燃烧反应的热化学方程式:
⑸的电子式为
⑹ 熔融状态下,的单质和能组成可充电电池(装置示意图如下),反应原理为:
2+  ;放电时,电池的正极反应式为
;放电时,电池的正极反应式为
、、、、五种元素分属三个短周期,且原子序数依次增大。、同主族,可形成离子化合物;、同主族,可形成、两种分子。
请回答下列问题:⑴ 在元素周期表中的位置为
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是
⑶ 、的单质或两元素之间形成的化合物可作水消毒剂的有
⑷ 的燃烧热,写出燃烧反应的热化学方程式:
⑸的电子式为
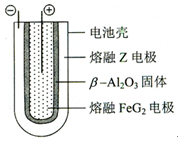
⑹ 熔融状态下,的单质和能组成可充电电池(装置示意图如下),反应原理为:
2+  ;放电时,电池的正极反应式为
;放电时,电池的正极反应式为
