是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:

(已知: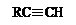 +
+ 

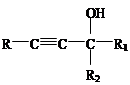 )
)
(1)的反应类型是
(2)中含有的官能团名称是
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含键。半方酸的结构简式是
(4)由和合成的化学方程式是
(5)下列关于的说法正确的是
a.能使酸性溶液或溴的溶液褪色
b.能与反应,但不与反应
c.能与新制反应
d.1完全燃烧消耗5
是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:

(已知: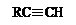 +
+ 

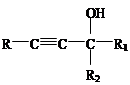 )
)
(1)的反应类型是
(2)中含有的官能团名称是
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含键。半方酸的结构简式是
(4)由和合成的化学方程式是
(5)下列关于的说法正确的是
a.能使酸性溶液或溴的溶液褪色
b.能与反应,但不与反应
c.能与新制反应
d.1完全燃烧消耗5